COMUNICACIÓN POSTER
AUTORES
Martínez Fernández, Isabel 1; Hernández Fernández, Francisco 1; null, Rosa 2; Feria Vilar, Inmaculada 1; null, Oscar 1; García García, Jorge 1; null, Rosa 3; Andrés López, Alberto 1; null, Cristina 4; null, Gemma 5; null, Elena 3; null, Luis 6; Sánchez Larsen, Alvaro 1; null, Blanca 1; González Villar, Esther 1; Restrepo Carvajal, Laura 1; Cuenca Juan, Fernando 1; Ocaña Mora, Beatriz 1; Sánchez Morales, Lidia 1; Torres López, Laura Esther 1; Segura Martín, Tomas 1
CENTROS
1. Servicio de Neurología. Complejo Hospitalario Universitario de Albacete; 2. Servicio: Anatomía patológica. Complejo Hospitalario Universitario de Albacete; 3. Servicio: Radiología. Complejo Hospitalario Universitario de Albacete; 4. Servicio de Neurocirugía. Complejo Hospitalario Universitario de Albacete; 5. Servicio: Neurociencias. Complejo Hospitalario Universitario de Albacete; 6. Servicio de Neurología. Complejo Hospitalario Universitario de Vigo
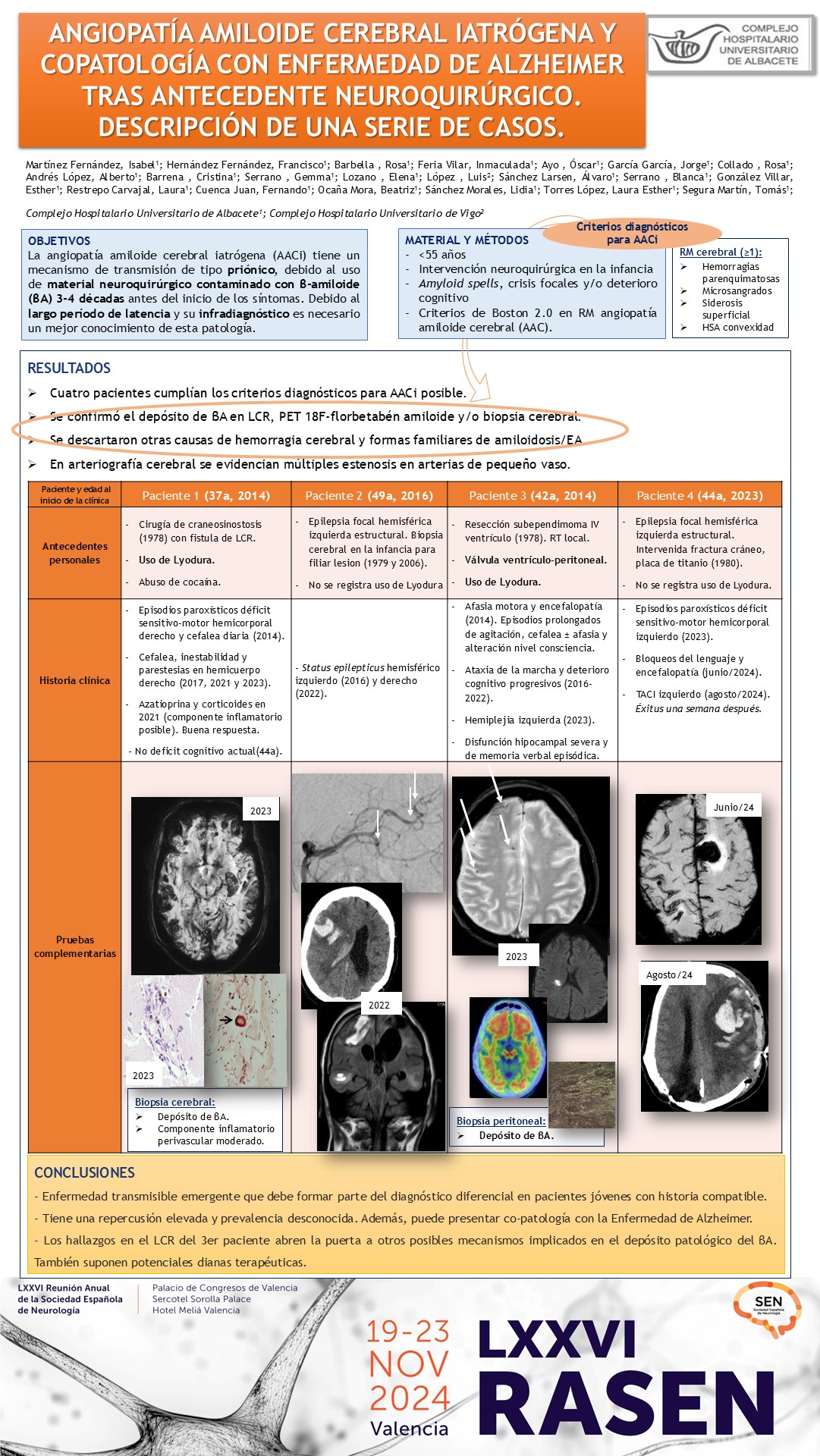
OBJETIVOS
La angiopatía amiloide cerebral iatrógena (AACi) tiene un mecanismo de transmisión de tipo priónico, debido al uso de material neuroquirúrgico contaminado con βA 3-4 décadas antes del inicio de los síntomas. Debido al largo período de latencia y su infradiagnóstico es necesario un mejor conocimiento de esta patología.
MATERIAL Y MÉTODOS
Revisamos aquellos pacientes atendidos en nuestro centro menores de 55 años que cumplían los criterios de Boston 2.0 para AAC en RM y que habían sido sometidos a una intervención neuroquirúrgica en la infancia, tal y como indican los criterios diagnósticos propuestos para AACi.
RESULTADOS
Presentamos cuatro pacientes intervenidos en su infancia que desarrollaron hemorragias cerebrales, déficits neurológicos focales transitorios y/o deterioro cognitivo. Se confirmó el depósito de βA con diferentes técnicas (PET-TC, biopsia cerebral y/o biomarcadores en LCR) y se descartaron otras causas de hemorragia cerebral y de formas familiares de amiloidosis y enfermedad de Alzheimer (EA) precoz. La angiografía de los tres primeros mostró irregularidades arteriales difusas de mediano y pequeño vaso. El tercer paciente fue diagnosticado además de EA por clínica compatible y biomarcadores en LCR; portador de una válvula peritoneal, presentaba también depósito de βA en el peritoneo.
CONCLUSIONES
Esta patología debe formar parte del diagnóstico diferencial en pacientes jóvenes con historia compatible. Es una enfermedad transmisible emergente de repercusión elevada y prevalencia desconocida que puede presentar además copatología con la EA. Los hallazgos en LCR de nuestro tercer paciente abren la puerta a otros posibles mecanismos implicados en el depósito patológico del βA, posicionándolos también como potenciales dianas terapéuticas.